โครงสร้างอะตอม
ดีโมครีตัส ( นักปราชญ์ชาวกรีก)
ได้กล่าวว่าทุกสิ่งทุกอย่างประกอบขึ้นจาก
อนุภาคที่เล็กมาก เล็กมากจนไม่สามารถมองเห็นได้ อนุภาคเล็กๆ
เหล่านี้จะรวมพวกเข้าด้วยกันโดยวิธิการต่างๆ สำหรับอนุภาคเองนั้นไม่มีการ
เปลี่ยนแปลงและไม่สามารถจะแตกแยกออกเป็นชิ้นส่วนที่เล็กลงไปอีกได้
ดีโมครี- ตัสตั้งชื่ออนุภาคนี้ว่า
อะตอม (Atom) จากภาษากรีกที่ว่า atoms
ซึ่งมีความหมายว่า
ไม่สามารถแบ่งแยกได้อีก
ตามความคิดเห็นของเขา
อะตอมเป็นชิ้นส่วนที่เล็กที่สุดของสสารที่สามารถจะคงอยู่ได้
ภาพการแปรียบเทียบขนาดของอะตอม
ประโยชน์จากการเรียนเรื่องโครงสร้างอะตอม
1. ทราบสมบัติทางเคมีและสมบัติการเปล่งแสงของธาตุ
2. เราสามารถศึกษาแกแล็กซี่ (galaxy) ดวงดาวและดาวเคราะห์ต่างๆ
โดยพิจารณาจากการศึกษาสเปกตรัมที่ได้จากดวงดาว
แบบจำลองอะตอมของจอห์นดอลตัน
จอห์น ดอลตัน
นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมโดยอาศัยข้อมูลจากการทดลองที่พอจะ
ศึกษาได้และนับว่าเป็นทฤษฎีแรกที่เกี่ยวกับอะตอมที่พอจะเชื่อถือได้
ซึ่งมีใจความดังนี้
- สารทุกชนิดประกอบด้วยอนุภาคขนาดเล็กที่สุดเรียกว่า “ อะตอม”
- อะตอมจะไม่สามารถแบ่งแยกได้ และไม่สามารถสร้างขึ้นใหม่ได้
- อะตอมของธาตุชนิดเดียวกันจะมีสมบัติเหมือนกันทุกประการ
- อะตอมของธาตุต่างกันจะมีสมบัติต่างกัน
- ธาตุตั้งแต่สองชนิดขึ้นไปสามารถรวมตัวกันเกิดเป็นสารประกอบ
โดยมีอัตราส่วนการรวมตัวเป็นตัวเลขอย่างง่าย
เช่น CO CO 2
จากทฤษฎีอะตอมของดาลตัน แบบจำลองอะตอมมีลักษณะดังรูป
ลักษณะแบบจำลองอะตอมของดอลตัน
( ตามทฤษฎีอะตอมของดอลตัน อะตอมในแนวคิดปัจจุบัน ข้อ 1, 3, 4
ใช้ไม่ได้ในปัจจุบัน)
ข้อ 1. อะตอมไม่ใช่สิ่งที่เล็กที่สุด
อะตอมยังประกอบด้วยอนุภาคอิเล็กตรอน, โปรตอน, นิวตรอน เป็นต้น
ข้อ 3 - 4
อะตอมของธาตุชนิดเดียวกันมีคุณสมบัติทางกายภาพไม่เหมือนกัน กล่าวคือมีมวลไม่เท่ากัน
ซึ่งจะได้กล่าวต่อไป ในเรื่อง " ไอโซโทรป"
แบบจำลองอะตอมของทอมสัน
- ทอมสัน ค้นพบ อิเล็กตรอน
- การทดลองของรอเบิร์ด แอนดรูส์ มิลลิแกน
ได้ผลการทดลองว่า อิเล็กตรอนมีประจุไฟฟ้าเท่ากับ 1.60 x 10 -19
คูลอมบ์ และอิเล็กตรอนมีมวลเท่ากับ 9.11 x 10 -28 กรัม
- โกลด์สไตน์ ค้นพบ โปรตอน
จากผลการทดลองของทอมสัน โกลด์สไตน์
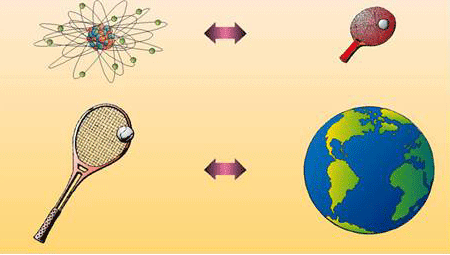
ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้นเขาจึงเสนอแบบจำลองอะตอมว่า
- อะตอมมีลักษณะเป็นทรงกลม
- อะตอมไม่ใช่สิ่งที่เล็กที่สุด
แต่อะตอมจะประกอบด้วยอิเล็กตรอน และอนุภาคอื่นๆอีก
- อะตอมประกอบด้วยอนุภาคอิเล็กตรอนที่มีประจุเป็นลบ
อนุภาคโปรตอนมีประจุเป็นบวก
- อะตอมจะมีโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ
- อะตอมเป็นกลางทางไฟฟ้า เพราะ มีจำนวนประจุบวกเท่ากับประจุลบ
จากทฤษฎีอะตอมของทอมสัน แบบจำลองอะตอมมีลักษณะดังรูป
ลักษณะแบบจำลองอะตอมของทอมสัน
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมจะประกอบด้วยนิวเคลียสที่มีโปรตอนและนิวตรอนรวมตัวกันอยู่อย่างหนา
แน่นอยู่ตรงกลางนิวเคลียสมีขนาดเล็กมากมีมวลมาก
และมีประจุบวกส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบและมีมวลน้อยมาก
จะวิ่งรอบนิวเคลียสเป็นวงกว้าง การค้นพบนิวตรอน
เนื่องจากมวลของอะตอมส่วนใหญ่อยู่ที่นิวเคลียสซึ่งเป็นมวลของโปรตอนแต่
โปรตอนมีมวลประมาณครึ่งหนึ่งของนิวเคลียสเท่านั้น
แสดงว่าต้องมีอนุภาคซึ่งไม่มีประจุไฟฟ้าแต่มีมวลใกล้เคียงกับโปรตอนอยู่ใน
อะตอมด้วย
เจมส์ แชวิก นักวิทยาศาสตร์ชาวอังกฤษ
จึงศึกษาทดลองเพิ่มเติมจนพบนิวตรอนซึ่งเป็นกลางทางไฟฟ้า
อะตอมของธาตุทุกชนิดในโลกจะมีนิวตรอนเสมอ
ยกเว้นอะตอมของไฮโดรเจนในรูปของไอโซโทป
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก
แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก
จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
จากทฤษฎีอะตอมของ รัทเทอร์ฟอร์ด แบบจำลองอะตอมมีลักษณะดังรูป
ลักษณะแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
แบบจำลองอะตอมของนีลส์โบร์
นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม
โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม
ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ
ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่
ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน
เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัว
สเปกตรัม หมายถึง
อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป
ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น
ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา
สรุปได้ดังนี้
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน
และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2.
อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น
ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n =
1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,...
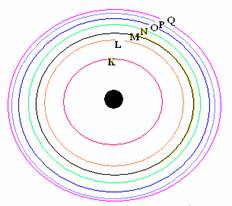
ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O
, P , Q ....
จากทฤษฎีอะตอมของ นีลส์โบร์ แบบจำลองอะตอมมีลักษณะดังรูป
ลักษณะแบบจำลองอะตอมของนีลส์โบร์
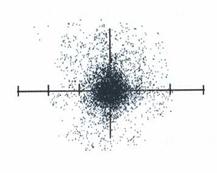
แบบจำลองอะตอมแบบกลุ่มหมอก
เป็นแบบจำลองที่นักวิทยาศาสตร์คิดว่าเป็นไปได้มากที่สุดทั้งนี้ได้จากการประมวลผลการทดลองและข้อมูลต่างๆ
อะตอมภายหลังจากที่นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา
อาจสรุปได้ดังนี้
1. อิเล็กตรอนไม่สามารถวิ่งรอบนิวเคลียสด้วยรัศมีที่แน่นอน
บางครั้งเข้าใกล้บางครั้งออกห่าง จึงไม่สามารถบอกตำแหน่งที่แน่นอนได้
แต่ถ้าบอกได้แต่เพียงที่พบอิเล็กตรอนตำแหน่งต่างๆภายในอะตอมและอิเล็กตรอนที่เคลื่อนที่เร็วมากจนเหมือนกับอิเล็กตรอนอยู่ทั่วไป
ในอะตอมลักษณะนี้เรียกว่า " กลุ่มหมอก"
2.
กลุ่มหมอกของอิเล็กตรอนในระดับพลังงานต่างๆจะมีรูปทรงต่างกันขึ้นอยู่กับจำนวนอิเล็กตรอน
และระดับพลังงานอิเล็กตรอน
3.
กลุ่มหมอกที่มีอิเล็กตรอนระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียสส่วนอิเล็กตรอนที่มีระดับพลังงานสูงจะอยู่ไกลนิวเคลียส
4. อิเล็กตรอนแต่ละตัวไม่ได้อยู่ในระดับพลังงานใดพลังงานหนึ่งคงที่
5. อะตอมมีอิเล็กตรอนหลายๆระดับพลังงาน
ลักษณะแบบจำลองอะตอมแบบกลุ่มหมอก
สรุปแบบจำลองอะตอม

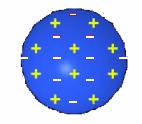
อนุภาคมูลฐานของอะตอม
ชนิดของอนุภาคมูลฐานของอะตอม
ทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน
และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส
นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย
และมีอิเล็กตรอนวิ่งรอบๆ นิวเคลียสด้วยความเร็วสูง
คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
อนุภาค
|
ประจุ ( หน่วย)
|
ประจุ (C)
|
มวล (g)
|
มวล (amu)
|
อิเล็กตรอน
|
-1
|
1.6 x 10 -19
|
0.000549
|
9.1096 x 10 -28
|
โปรตอน
|
+1
|
1.6 x 10 -19
|
1.007277
|
1.6726 x 10 -24
|
นิวตรอน
|
0
|
0
|
1.008665
|
1.6749 x 10 -24
|
' อิเล็กตรอน (Electron) สัญลักษณ์ e - มีแระจุลบ และมีมวลน้อยมาก
' โปรตอน
สัญลักษณ์ p + มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน ( เกือบ 2,000 เท่า)
' นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆ กับโปรตอน
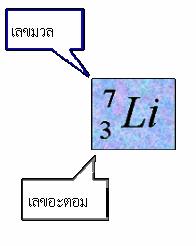
เลขอะตอม เลขมวล และสัญลักษณ์นิวเคลียร์
1. จำนวนโปรตอนในนิวเคลียสเรียกว่า
เลขอะตอม (atomic number,
Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า
เลขมวล (mass
number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
( เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน (A)
ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน (Z)
ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
คำศัพท์ที่ควรทราบ
ไอโซโทป ( Isotope ) หมายถึง
อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน เช่น
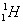
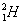
 ไอโซบาร์ ( Isobar )
ไอโซบาร์ ( Isobar ) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน
แต่มีเลขอะตอมไม่เท่ากัน เช่น

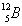 ไอโซโทน ( Isotone )
ไอโซโทน ( Isotone ) หมายถึง
อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน เช่น
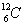
การหาอนุภาคมูลฐานของอะตอม จากสัญลักษณ์นิวเคลียร์
ดังนั้น อะตอมของธาตุลิเทียม ( Li )
มีจำนวนโปรตอน = 3 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
การจัดเรียงอิเล็กตรอน
หลักในการจัดเรียงอิเล็กตรอนในอะตอม
1. อิเล็กตรอนที่วิ่งอยู่รอบๆ นิวเคลียสนั้น จะอยู่กันเป็นชั้นๆตามระดับพลังงาน
ระดับพลังงานที่อยู่ใกล้นิวเคลียสที่สุด ( ชั้น K) จะมีพลังงานต่ำที่สุด
และอิเล็กตรอนในระดับพลังงานชั้นถัดออกมาจะมีพลังงานสูงขึ้นๆ ตามลำดับ
พลังงานของอิเล็กตรอนของระดับชั้นพลังงาน K < L < M < N < O < P
< Q
หรือชั้นที่ 1< 2 < 3 < 4 < 5 < 6 < 7
แบบจำลองอะตอมของนีลส์โบร์
2. ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n 2 เมื่อ n =
เลขชั้น ซึ่งเลขชั้นของชั้น K=1,L=2,M=3,N=4,O=5,P=6 และ Q=7
ตัวอย่าง จำนวน e - ในระดับพลังงานชั้น K
มีได้ ไม่เกิน 2n 2 = 2 x 1 2 = 2x1 =
2
จำนวน e - ในระดับพลังงานชั้น N มีได้ ไม่เกิน 2n 2 = 2 x 4 2 = 2x16 = 32
ระดับพลังงาน
|
จำนวนอิเล็กตรอนที่มีได้มากที่สุด
|
n = 1 (K)
|
2(1) 2 = 2
|
n = 2 (L)
|
2(2) 2 = 8
|
n = 3 (M)
|
2(3) 2 = 18
|
n = 4 (N)
|
2(4) 2 = 32
|
n = 5 (O)
|
2(5) 2 = 32 ( 32 คือ เลขมากสุดที่เป็นไปได้ )
|
n = 6 (P)
|
2(6) 2 = 32
|
n = 7 (Q)
|
2(7) 2 = 32
|
จะเห็นว่ากฎออกเตตมีข้อด้อย คือ เมื่อระดับพลังงานมากกว่า n = 4 จะใช้ไม่ได้
อย่างไรก็ตามในธาตุ 20 ธาตุแรก สามารถใช้การจัดเรียงอิเล็กตรอนตามกฎออกเตตได้ดี
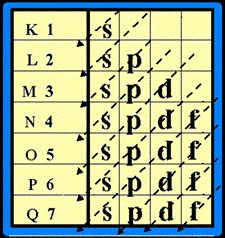
3. ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย
และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
ในแต่ละชั้นย่อย จะมีจำนวน e - ได้ ไม่เกิน
ดังนี้
ระดับพลังงานชั้นย่อย s มี e - ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e -
ได้ ไม่เกิน 6 ตัวระดับพลังงานชั้นย่อย d มี e - ได้ ไม่เกิน 10 ตัว
ระดับพลังงานชั้นย่อย f มี e - ได้ไม่เกิน 14 ตัว เขียนเป็น s 2 p 6 d 10 f 14
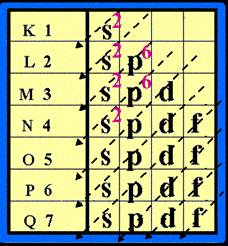
วิธีการจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอน ให้จัดเรียง e-
ในระดับพลังงานชั้นย่อยโดยจัดเรียงลำดับตามลูกศร ( แนวทางการจัดเรียงอิเล็กตรอน
ให้เขียนแผนผังก่อน ดังรูป
จัดเรียงอิเล็กตรอนตามลูกศร ดังรูป
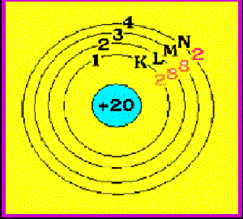
ตัวอย่าง จงจัดเรียงอิเล็กตรอนของธาตุ คัลเซียม (
Ca )
ธาตุ Ca มีเลขอะตอม = 20 แสดงว่ามี p = 20 และมี e- = 20 ตัว ( ดูเลขอะตอม
จากตารางธาตุ)
แล้วจัดเรียง e- ดังนี้
ดังนั้น การจัดเรียง e- ของธาตุ Ca = 2 , 8 , 8 , 2
มีแผนผังการจัดเรียง e- ดังนี้ Ca มีจำนวน e- ในระดับพลังงานชั้นนอกสุด = 2 ตัว
จำนวนอิเล็กตรอนในระดับพลังงานชั้นนอกสุด เรียกว่า เวเลนซ์อิเล็กตรอน (
Valence
electron) ดังนั้น Ca มีเวเลนซ์อิเล็กตรอน = 2 ดังรูป





 พันธะเคมี
พันธะเคมี


